Blog
Quality by Design für Reinräume
Wie implementiere ich die Anforderungen bei einem Neubau für B/C Zonen?
Hersteller von Steril-Produkten sind beim flexiblen Design von Neubauten mit der Umsetzung des Zonen-Konzepts gefordert.
Egal ob Spitalapotheke, Lohnhersteller oder Hersteller von Originalpräparaten, ein wichtiger Bestandteil in der Konzeptionierung ist die hohe Flexibilität, sowie eine lückenlose Dokumentation für die Markteinführung und Betriebszulassung. Nur so kann sich ein Betrieb langfristig am Markt behaupten.
Der Markt verlangt neue Technologien (z.B. neuartige Isolatoren, Roboter, BFS) für das Handling von Arzneimittel bei neuartigen Therapien (engl.: ATMP: advanced therapy medicinal product). Bisher war die Flexibilität durch eine Kombination von Barrier Isolator/Biosafety Cabinets/closed RABS-Technologien gewährleistet.
Mit diesem Artikel möchten wir einen Ausschnitt (nicht komplett) aufzeigen, welcher sich auf die wesentlichen Kriterien von der Planung bis zur Übergabe eines B-/C-Zonenbereiches fokussiert.

Ausgangsituation:
Zonenklasse B: ≈ ISO 5 (at rest), ≈ ISO 7 (in operation)
Hintergrund von Zone A wo die aseptische Zubereitung und Abfüllung stattfinden soll
Zonenklasse C: ≈ ISO 7 (at rest), ≈ ISO 8 (in operation)
Lösungsansatz für die aseptische Abfüllung, bzw. Abfüllung für Produkte, welche endsterilisiert werden
Projektablauf
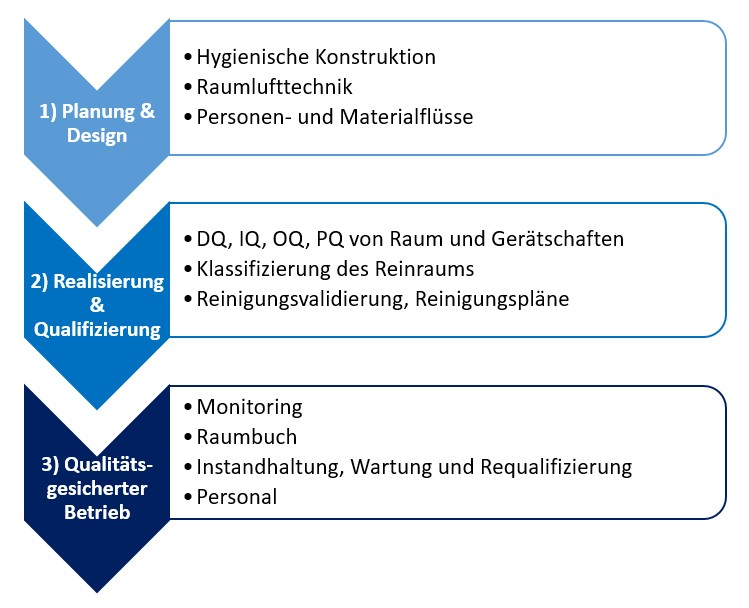
1) Planung und Design
Hygienische Konstruktion:
• Glatte, undurchlässige Oberflächen ohne Risse
• Keine unzugänglichen Nischen
• Versiegelte Decken
• Keine Ausgüsse und Abflüsse in Raumklasse A und B
• Überdruck von der reinen Seite zur unreinen Seite (Ausnahme aseptisch toxisch)
Raumlufttechnik:
• Belüftung über Filter mit angemessener Wirksamkeit → für reine Räume zwei Partikelluftfilterstufen und als dritte Stufe, ein Schwebstofffilter
• Turbulente Verdünnungs- oder Mischströmung (stetige Verdünnung der Partikelkonzentration)
• In Ausnahmefällen: laminare Strömungen
• Einsatz von CFD-Tools im Planungsprozess
• geeignete Personen- und Materialflüsse
• Verhinderung von Verwechslungen und Kontaminationen
Schleusen
• Umkleidekabine als Schleuse auslegen: letzte Zone sollte at rest dieselbe Reinheitsklasse aufweisen wie der anschliessende Raum
• «Aktive Mouseholes» (Materialdurchreiche belüftet) zur Trennung von Zonen
2) Qualifizierung - Überprüfung der Eignung
Risikobasierte Qualifizierung erfolgt nach den FDA 21 CFR Part 210-211 Anforderungen.
Phasen der Qualifizierung in Bezug auf das RR-Konzept:


Klassifizierung des Reinraums nach EN ISO 14644 (OQ):
Für die messtechnischen Verfahren verweisen wir gerne auf unsere Homepage:
www.pharmatronic.ch/wordpress/wp-content/uploads/2019/05/pharmatronic_portfolio_reinraum_DE.pdf
Reinigungsvalidierung / Reinigungspläne:
Die Betriebshygiene in reinen Bereichen ist besonders wichtig. Aus diesem Grund ist nach Qualifizierung des Raumes auch noch eine Reinigungsvalidierung durchzuführen, um Kontaminationen vorbeugen zu können und Partikelwerte tief halten zu können:
• Reine Bereiche sollten häufig und gründlich nach einem schriftlich festgelegtem Plan gereinigt und durch Abklatschplatten geprüft werden
• Mehrere Typen Desinfektionsmittel sollten verwendet und regelmässige Kontrollen auf Resistenzen bei Mikroorganismen durchgeführt werden. Wechselwirkungen zwischen Reinigungsmitteln sollten validiert sein
• Eine angemessene Reinigungsvalidierung sollte ausgeführt werden, um zu gewährleisten, dass Rückstände von Desinfektionsmitteln erkannt und entfernt werden
• Detergenzien und Desinfektionsmittel sollten auf mikrobielle Verunreinigung überprüft werden. Desinfektionsmittel sollten vor Gebrauch steril sein (für Klasse A und B)
• Desinfektionsprogramm sollte auch ein sporizides Mittel einschliesse
• Manuelle Wischdesinfektion bzw. automatisierte Raumdekontamination mit H2O2
3) Qualitätsgesicherter Betrieb
Monitoring mit Warn- und Aktionsgrenzen für (risikobasiert, bzw. kontinuierlich):
• Differenzdruck
• Luftgetragene Partikel
• Mikrobielle Verunreinigungen
• Oberflächenreinheit
• Temperatur und relative Feuchte
• Probenahme: Sedimentationsplatten, Entnahme von Luftproben, Tupfer
• Warn- und Eingriffsgrenzen definieren
• Monitoringsysteme müssen ebenfalls qualifiziert und validiert werden
Raumbuch:
• Erstellen für die Bestandserfassung wie für Wartungs- und Qualifizierungszwecke Instandhaltung und Wartung
• Routinemässig den Betriebszustand überwachen
Re-Qualifizierung (Intervall risikobasiert):
• Bestätigung Luftreinheitsklasse
• Nachweis Druckkaskade
• Luftgeschwindigkeit, bzw. Luftvolumenstrom
• Dichtheit der Raumbegrenzungsflächen
• Wiederholung Lecktest der Schwebstofffilter (nach FDA alle 6 Monate, Empfehlung PIC/S PI032-2 einmal jährlich)
Personal:
• Hygiene: hoher Standard an persönlicher Hygiene und Sauberkeit, regelmässige Gesundheitskontrollen. Umkleidung und Waschen nach festgelegten Verfahren
• Schulung: regelmässige Schulung (Hygiene, Grundlagen Mikrobiologie)
• Bekleidung: der Reinheitsklasse entsprechende Kleidung
Ungezieferkontrolle:
• Eindringen von Insekten und anderen Tieren (u.a. Kreuzkontamination, usw.) muss verhindert werden
Schlussfolgerungen für den Betrieb und Hausaufgaben für die Bauherrschaft:
• Prüfung der Wartungs- und Kalibriervorschriften der Messeinheiten
• Wartungs- und Instandhaltungsvorschriften für Reinraumkomponenten (Belüftung, Beleuchtung, usw.)
• Benennung des Qualifizierungsbeauftragten
• Beschaffung genügend Ersatz HEPA-Filter (Zertifikate, Konformitätserklärungen notwendig)
Bauherrenleistungen können bis etwa zur Hälfte an eine Bauherrenvertretung delegiert werden.
Gerne beraten wir Sie als kompetenter Partner ab der Projektidee bis zur Übergabe an die Produktion.
Für weitere Informationen wenden Sie sich bitte an:
|
Pharmatronic AG
|
|
Vito Cerone
|
Es freut uns, wenn Sie diesen Blogbeitrag kommentieren. Kommentar erfassen 109 Gefällt mir 579